Molnupiravir, que está na última fase de testes em humanos e pode ser lançado até o fim do ano, introduz erros de cópia no RNA, impedindo que o coronavírus se replique. O problema: segundo um estudo, ele também pode fazer isso no código genético das células.
O medicamento, que foi criado pela Emory University e está sendo desenvolvido pelo laboratório Merck, já começou os testes de Fase III, a última antes que ele receba aprovação dos órgãos regulatórios. O fabricante pretende colocar o molnupiravir no mercado ainda este ano. Ele vem tendo bons resultados. Reduziu em 100 vezes a quantidade de Sars-CoV-2 nos pulmões de hamsters, e também demonstrou eficácia em humanos – em um teste feito pela Merck com 202 voluntários, nenhuma das pessoas tratadas com o remédio tinha coronavírus no organismo após cinco dias (contra 24% dos que receberam placebo).
O molnupiravir é considerado especialmente promissor porque é administrado por via oral, em cápsulas, e por isso poderia ser tomado em casa (já o remdesivir, o outro antiviral disponível contra o Sars-CoV-2, é uma infusão intravenosa e precisa ser aplicado em hospital). A ideia é que o medicamento comece a ser usado logo que a pessoa for diagnosticada com coronavírus, para evitar que a Covid piore.
Ele tem um mecanismo de ação interessante. Assim que entra no organismo, o molunupiravir é metabolizado e se transforma em outra substância, a N4-hidroxicitidina (NHC), uma molécula que interfere com o processo normal de cópia do Sars-CoV-2. Quando o vírus vai se replicar, a NHC se insere em vários pontos do código genético dele. Isso provoca grande quantidade de erros, que impedem a cópia do vírus.
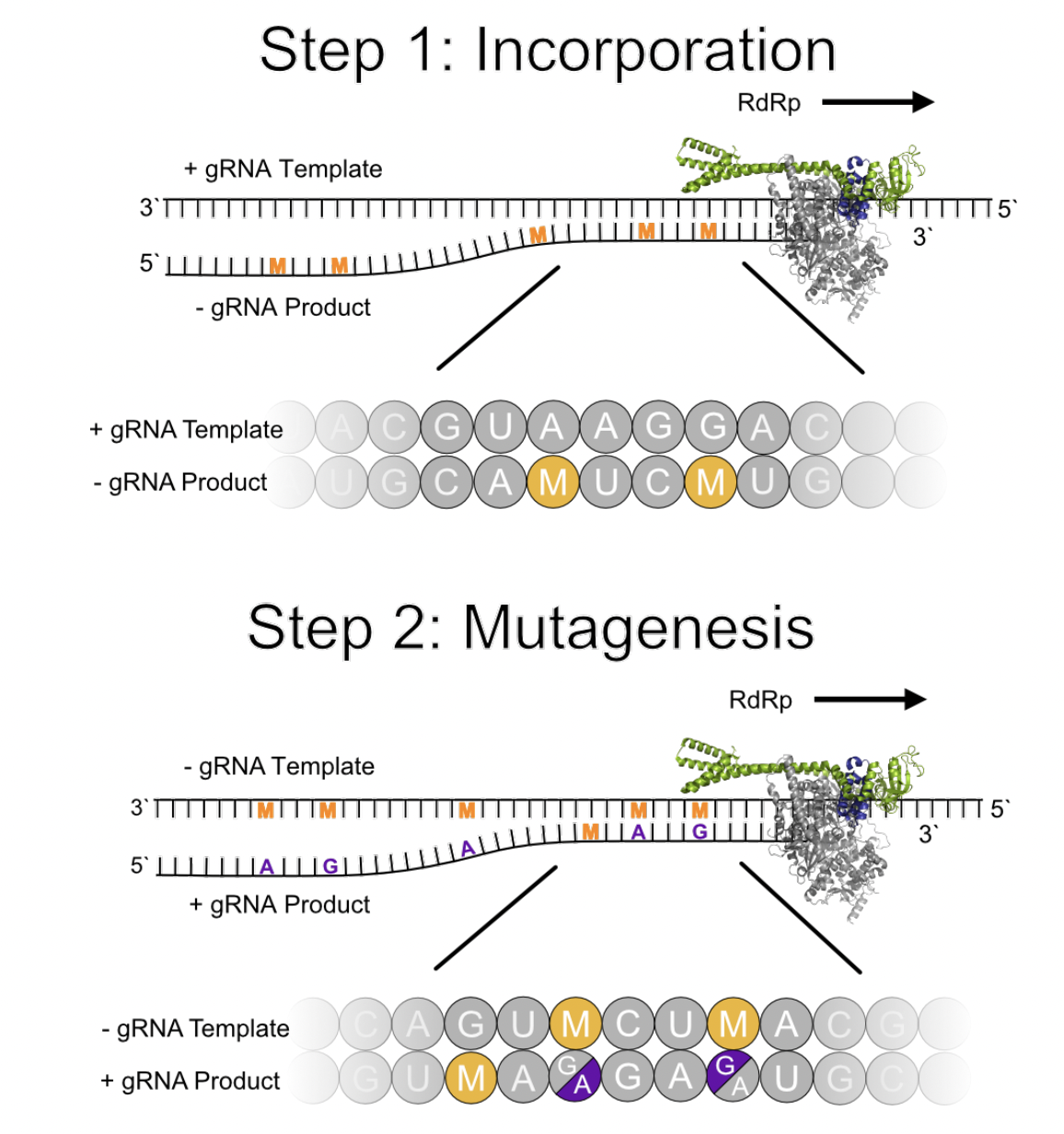
Por isso, o medicamento também funciona contra outros vírus de RNA. Ele começou a ser desenvolvido em 2014 pela Emory University, a pedido da Defense Threat Reduction Agency (DTRA, uma agência do governo americano). Os militares queriam um remédio contra o vírus da encefalite equina (VEE), que também infecta humanos e é considerado uma possível arma biológica. O molnupiravir se mostrou eficaz contra esse vírus e contra o ebola, o chicungunha e o H1N1.
Em abril de 2020, a droga começou a ser testada em humanos contra o Sars-CoV-2. Nessa mesma época, o imunologista Rick Bright foi afastado do cargo de diretor da US Biomedical Advanced Research and Development Authority (BARDA, uma agência irmã da DTRA). Segundo Bright, isso aconteceu porque ele se posicionou contra a cloroquina (defendida pelo então presidente Donald Trump) e não quis financiar testes do molnupiravir em humanos. Isso porque esse remédio, que na época era conhecido apenas por seu nome de desenvolvimento, EIDD-2801, poderia ter um efeito colateral bem perigoso.
Além de atrapalhar e inviabilizar o processo de cópia dos vírus, a molécula também poderia interferir com a transcrição do código genético humano, resultando em mutações no DNA. “Drogas experimentais similares já mostraram toxicidade reprodutiva, e os filhotes de animais tratados nasceram sem os dentes e sem pedaços dos crânios”, afirmou Bright. Também há o receio de que elas sejam oncogênicas, ou seja, possam levar ao surgimento de câncer.
“O molnupiravir tem potencial considerável como antiviral contra o Sars-CoV-2, no começo da infecção, especialmente em pacientes sob alto risco [de Covid grave]. Porém, o uso clínico deve ser cuidadosamente considerado, à luz de seus potenciais efeitos mutagênicos no hospedeiro”, afirma um estudo assinado por dez cientistas da Universidade da Carolina do Norte e da própria Emory University. Eles fizeram testes com células de ovário de hamster, que foram colocadas em contato com a droga – e apresentaram mutações em um gene chamado HPRT. “Os riscos para o hospedeiro podem não ser zero, e precisam ser avaliados com cuidado”, diz o texto.
Eram células de hamster, não humanas, e foram expostas ao molnupiravir durante 32 dias (bem mais tempo do que o uso planejado do remédio, 5 dias). Mas a principal ressalva é que esse teste foi in vitro, ou seja, fora do organismo.
Uma segunda equipe de cientistas fez um teste in vivo, em que hamsters foram infectados com o vírus Mers-CoV e receberam o medicamento por via oral. Nesse caso, o resultado foi diferente. “Mesmo numa dose de 500 mg/kg [20 vezes mais alta do que a proposta para humanos], o tratamento (…) não aumentou as taxas de mutação na transcrição do ISG15, um gene altamente induzido durante a infecção pelo Mers-CoV, enquanto os genes do vírus acumularam mutações”.
São dois estudos diferentes, que observaram marcadores genéticos distintos; por isso, não é possível afirmar que um se sobrepõe ao outro. Também vale lembrar que outro antiviral, o remdesivir, foi aprovado pela FDA, pela EMA (a agência de regulação médica europeia) e pela Anvisa em 2020 para o tratamento da Covid – e ele usa um mecanismo de ação parecido (porém não igual), sem que isso tenha levantado preocupações quanto à indução de mutações nas células. Em junho, a Merck assinou um pré-contrato de US$ 1,2 bilhão com o governo dos EUA para fornecer 1,7 milhão de doses do medicamento, caso ele venha a ser aprovado.
Novo antiviral elimina o Sars-CoV-2 do organismo. Mas há um porém Publicado primeiro em https://super.abril.com.br/feed
Nenhum comentário:
Postar um comentário